C.0.1 医药洁净室(区)的验证,应包括下列内容:
1 医药洁净室(区)的验证,应包括室内系统及设施,如净化空气、工艺用水等系统及设施的安装确认、运行确认和性能确认。
2 系统及设施的安装确认,应包括各分部工程的外观检查和单机试运转。
3 系统及设施的运行确认,应在安装确认合格后进行。内容应包括带冷(热)源的系统联合试运转,并不应少于8h。
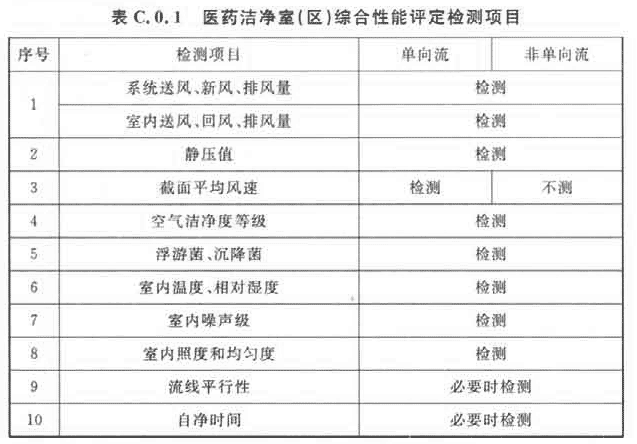
4 医药洁净室(区)的综合性能确认,应包括表C.0.1项目的检测和评价。
C.0.2 医药洁净室(区)的验证,应符合下列规定:
1 国家现行标准《洁净室施工及验收规范》JGJ 71。
2 现行国家标准《医药工业洁净室(区)悬浮粒子的测试方法》GB/T 16292。
3 现行国家标准《医药工业洁净室(区)浮悬菌的测试方法》GB/T 16293。
4 现行国家标准《医药工业洁净室(区)沉降菌的测试方法》GB/T 16294。
5 国家现行《药品生产质量管理规范》。
6 现行《中华人民共和国药典》。
C.0.3 医药洁净室(区)的验证,应包括下列文件:
1 医药洁净室(区)主要设计文件和竣工图。
2 主要设备的出厂合格证书、检验文件。
3 设备开箱检查记录、管道压力试验记录、管道系统吹洗脱脂记录、风管漏风记录、竣工验收记录。
4 单机试运转、系统联合试运转和医药洁净室(区)性能测试记录。
上一篇:医药洁净厂房设计文本规范用词说明
电子光学案例
PURIFICATION CASE
生物制药案例
PURIFICATION CASE
医疗器械案例
PURIFICATION CASE
食品日化案例
PURIFICATION CASE